 Los ensayos clínicos son estudios de investigación que sirven para comprobar la seguridad y eficacia de nuevos fármacos. Esto es clave, para poder someter un medicamento a la aprobación por parte de las Agencias del Medicamento.
Los ensayos clínicos son estudios de investigación que sirven para comprobar la seguridad y eficacia de nuevos fármacos. Esto es clave, para poder someter un medicamento a la aprobación por parte de las Agencias del Medicamento.
Un ensayo es un proceso serio, largo y cuidadoso, que puede durar 6 – 7 años, y en el que se involucran, junto a la compañía farmacéutica promotora, autoridades, investigadores, centros hospitalarios y pacientes.
Primero, los investigadores estudian un tratamiento nuevo en el laboratorio. Luego, en animales. Si un tratamiento se muestra prometedor, prueban el tratamiento en ensayos clínicos con humanos. Los investigadores hacen esto en tres o cuatro fases con propósitos diferentes cada una de ellas.
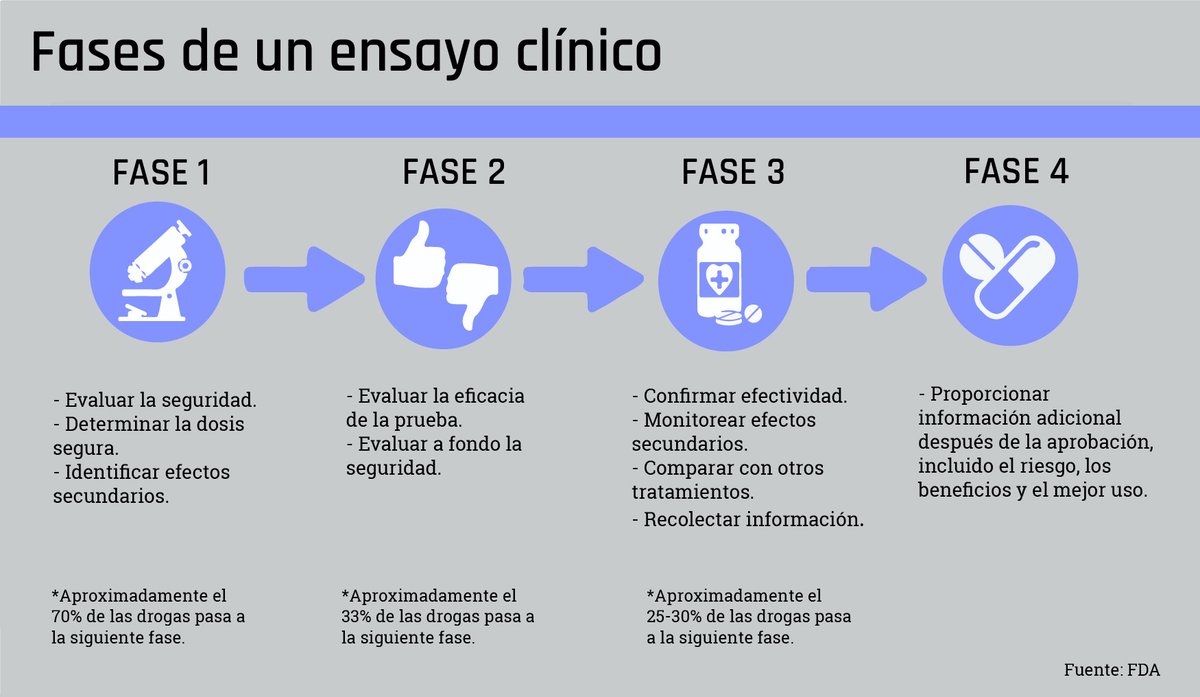
Fases de los Ensayos Clínicos
Ensayos de Fase I
El objetivo de los ensayos de fase I es:
• Averiguar si un tratamiento es seguro.
• Encontrar el mejor modo de administrar el tratamiento nuevo, como por ejemplo por boca o por vena.
Representa la primera administración en humanos, generalmente en pequeño número, que rara vez es mayor de 100. Para esta fase, la administración se realiza generalmente en adultos jóvenes sanos de sexo masculino, con el fin de detectar posibles signos incipientes de toxicidad, lo que permitiría determinar luego el rango seguro de dosificación.
Ensayos de Fase II
Si la etapa anterior es satisfactoria, se pasa a esta fase II, la cual involucra la administración del fármaco a personas que presentan la enfermedad para la que se ha concebido su empleo.
Este grupo de pacientes debe ser relativamente homogéneo en sus características (presentar solo la enfermedad en cuestión) y se suelen incluir de 100 a 200 personas. Se dividen en dos grupos, donde se comparan entre sí. El primer grupo (grupo control) usa los mejores medicamentos disponibles para el tratamiento de la enfermedad o un placebo, y el segundo grupo de estudio, con el fármacos nuevo en investigación.
La finalidad de la fase II es la de establecer mediciones preliminares de la relación eficacia terapéutica/toxicidad, así como establecer la dosis óptima.
Ensayos de Fase III
Si se obtiene razonable evidencia en las fases I y II, comienzan los estudios de fase III, que pueden involucrar múltiples médicos tratando cientos o incluso miles de pacientes.
Aparte de verificar la eficacia del medicamento, se busca determinar manifestaciones de toxicidad previamente no detectadas. En esta fase se obtiene una mejor perspectiva de la relación entre seguridad y eficacia.
Como en la fase anterior, cada paciente inscrito en un ensayo clínico de fase III tiene una probabilidad de estar en uno de los siguientes grupos:
Grupo de control: el grupo que recibe el tratamiento estándar o placebo
Grupo de estudio: el grupo que recibe el tratamiento nuevo que se está probando
¿Cómo se asignan los pacientes a los grupos?
Un ordenador decide qué pacientes están en el grupo de control y cuales están en el grupo de estudio. Los pacientes tienen la posibilidad de estar en cualquier grupo. El paciente y el médico no deciden. Es aleatorio y se debe tan solo al azar. Esto ayuda a evitar sesgos en el ensayo clínico. (El sesgo ocurre cuando las opciones humanas afectan a los resultados de un estudio)
¿Sabrá mi médico en qué grupo me encuentro yo?
En los estudios ciego simple, los pacientes no saben si están o no están en el grupo de control o en el grupo de estudio, pero el médico si lo sabe. Cuando los estudios doble ciego, ni los pacientes ni los médicos saben qué pacientes están en cada grupo. (En el caso de una emergencia, los médicos pueden encontrar esta información en el archivo del estudio.)
¿Me administrarán un placebo?
El placebo es una sustancia que carece de actividad farmacológica. Esto permite a los médicos comparar el tratamiento estándar con una medicina nueva.
Después de los ensayos de fase III, la Agencia del Medicamento revisa los resultados clínicos para asegurarse de que el tratamiento es seguro y eficaz para el uso de las personas. La Agencia decide si aprobar o no el tratamiento para que esté disponible para todos los pacientes.
Ensayos de Fase IV
También conocidos como estudios de farmacovigilancia, consisten en el seguimiento del fármaco después de que ha sido aprobado por las Agencias del Medicamento y comercializado.
El objetivo es continuar estudiando los efectos secundarios del nuevo tratamiento, básicamente la detección de toxicidad previamente insospechada, así como de la evaluación de la eficacia a largo plazo.
En la fase IV se pueden detectar reacciones adversas raras, mientras que en las fases previas es excepcional este descubrimiento. También se pueden valorar aspectos nuevos o desconocidos del fármaco que no se hayan probado en las fases anteriores, de tal forma que es posible encontrar aplicaciones potenciales no previstas inicialmente.
Participación en un Ensayo Clínico
No todos los ensayos clínicos son adecuados para todos los pacientes. Un ensayo puede ser seguro para un paciente, pero no ser seguro para otro con la misma enfermedad. Cada estudio se rige conforme a lo establecido en un protocolo de reglas estrictas que los médicos deben seguir para decidir quién puede participar en el estudio clínico. Estas reglas, son entre otras, los criterios de inclusión y exclusión. Esto protege a los pacientes de recibir tratamientos que pueden dañarles.
Los criterios incluyen información sobre el paciente y su estado general de salud. Algunos de estos son:
- Edad y sexo
- Resultados de pruebas médicas
- Medicinas que está tomando
- Cualquier otro problema de salud…
- Tipo de ELA y fase
- Cuánto tiempo ha pasado desde los primeros síntomas…
Hay que tener en cuenta que, aunque un paciente cumpla los requisitos de inclusión, si es seleccionado para participar, le puede tocar el grupo de control o el medicamento. Un programa de ordenador divide los grupos, y es aleatorio.
Si has encontrado un ensayo clínico en el que crees que quieres o puedes participar, habla con tu médico para ver si estás dentro de los criterios de inclusión.