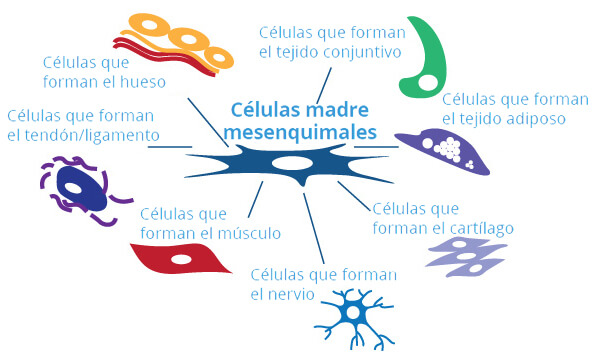
Murcia y Alicante continúan reclutando a pacientes ELA sin límite de tiempo de evolución de la enfermedad, para un ensayo fase II con células madre mesenquimales. Los investigadores de este ensayo, tratan de infiltrar células madres procedentes de la médula ósea del propio paciente, en dos músculos de su cuerpo, uno de la pierna y otro de la mano.
No es un ensayo en el que se pretenda modificar la supervivencia ni el estado funcional de los pacientes. La participación en el mismo no supone una ventaja en esos términos para los pacientes. Aunque sí permitirá a los investigadores confirmar algunos resultados obtenidos en estudios previos, conocer mejor la enfermedad y avanzar en la investigación para su curación.
El ensayo clínico está en marcha en tres Hospitales:
- Clínico Universitario Virgen de la Arrixaca, en Murcia
- Universitario San Juan, en Alicante
- General Universitario Dr. Balmis , en Alicante
Para más información, pueden contactar con el equipo investigador en el correo: ensayoclinicoela@gmail.com
Objetivo Principal
- Determinar si la infusión de CMN puede detener o enlentecer la pérdida progresiva de unidades motoras funcionales en dichos músculos.
- Estudiar, en una muestra suficiente de pacientes con ELA, si el diferente grado de afectación y la diferente evolución del proceso patológico en músculos diferentes, característica muy típica de esta enfermedad, se traduce en una eficacia distinta de la inyección intramuscular de CMN de MO. La heterogeneidad clínica y la presencia de músculos con distinto grado de afectación se completará con estudios genéticos
- Determinar la seguridad del procedimiento.
Criterios de Inclusión
- Diagnóstico de ELA definida o probable sin importar la fecha del diagnóstico.
- Edad comprendida entre los 18 y los 70 años.
- Paciente que ofrezca garantías suficientes de adhesión al protocolo.
- Datos neurofisiológicos que confirmen afectación de motoneurona inferior a nivel lumbar y cervical.
- Valoración del déficit motor en la flexión dorsal de ambos pies (entre 3 y 5 puntos en la escala MRC), esto es elevar suficientemente la punta del pie.
Criterios de Exclusión
- Diabetes Mellitus.
- Otras enfermedades que puedan cursar con polineuropatías.
- Historia previa de ictus cerebral.
- Patología previa del sistema nervioso periférico que afectara a uno o ambos miembros inferiores o superiores.
- Pacientes embarazadas o en período de lactancia activa
- Personas fisiológicamente capaces de quedarse embarazadas, excepto que estén utilizando un método anticonceptivo fiable.
- Con enfermedad cardiaca, renal, hepática, sistémica, inmune que pueda influir en la supervivencia del paciente durante el ensayo.
- Serología positiva para hepatitis B, hepatitis C o VIH.
- Criterios clínicos y anestesiológicos que contraindiquen bien la sedación o bien la propia extracción de MO (Alteración del sistema de la coagulación o paciente anticoagulado con imposibilidad para retirar la anticoagulación, inestabilidad hemodinámica, alteración cutánea en la zona de punción, etc.)
- Inclusión en otros ensayos clínicos en los últimos 6 meses.
- Incapacidad de comprender el consentimiento informado.
Fuente de la Información: Agencia Española del Medicamento y Productos Sanitarios